海创药业:5月15日接受机构调研,包括知名机构明汯投资的多家机构参与
来源:证星公司调研
2025-05-30 22:07:25
证券之星消息,2025年5月30日海创药业(688302)发布公告称公司于2025年5月15日接受机构调研,华福证券、平安养老保险、平安基金、深投控、首创证券、兴业证券、宝盈基金、西部自营基金、国投瑞银基金、长江证券资管、明汯投资、诺安基金、人保资产管理、长信基金、湘财基金、南华基金、川发展弘科基金、齐盛基金、长城证券、华西证券、山西证券、恒泽基金、川投大健康、国泰海通证券、华安基金、永赢基金、前海开源基金、天风证券参与。
具体内容如下:
问:公司核心产品氘恩扎鲁胺软胶囊(项目号:HC-1119)的审评进展?
答:氘恩扎鲁胺软胶囊(HC-1119)的新药上市申请于2023年11月获国家药品监督管理局(NMP)药品审评中心(CDE)受理,截至本记录表发布日,氘恩扎鲁胺软胶囊已获批上市。公司首款自主研发的1类创新药氘恩扎鲁胺软胶囊成功获批,对公司经营发展具有重要意义。
氘恩扎鲁胺软胶囊(曾用名HC-1119软胶囊)是公司自主研发的、用于治疗转移性去势抵抗性前列腺癌(mCRPC)的1类新药,是第二代雄激素受体(R)抑制剂,获得国家重大新药创制科技重大专项支持。氘恩扎鲁胺(HC-1119)中国Ⅲ期临床研究达到主要终点,数据显示,相较于对照组,氘恩扎鲁胺显著延长患者无进展生存期(PFS),并将疾病进展或死亡风险降低42%(HR=0.58,95%CI0.439-0.770;p=0.0001)。氘恩扎鲁胺(HC-1119)在中国开展的Ⅲ期临床数据入选2023年6月美国临床肿瘤学会(SCO)年会,氘恩扎鲁胺的HC-1119-04注册研究纳入了2023版CSCO前列腺癌诊疗指南。氘恩扎鲁胺软胶囊是国内首款获批上市治疗该适应症的国产创新药物,相较于其他新型内分泌药物,氘恩扎鲁胺软胶囊在安全性方面表现优异,可显著降低中枢神经系统不良事件(如癫痫、跌倒等)发生率,且无皮疹相关不良反应,同时减少老年患者常见并发症风险。
根据GLOBOCN 2022数据,前列腺癌是常见的泌尿系统恶性肿瘤,位居全球男性癌症发病率的第二位和癌症死亡率的第五位,2022年全球前列腺癌新发病例数达到146.7万。近年来,中国前列腺癌的发病率呈现上升趋势,2022年中国前列腺癌新发病例数达到13.4万人。对于转移性去势抵抗性前列腺癌,内分泌治疗仍是推荐的首选治疗方式。
问:请介绍HP515项目进度?
答:HP515是公司自主研发的一种口服高选择性THR-β(甲状腺激素受体β亚型)激动剂,HP515与GLP-1R激动剂联合使用在增强减重效果同时保持瘦体重/体重比方面具有潜力。HP515联合GLP-1R激动剂用于肥胖症的临床前研究数据于2025年5月13日在西班牙马拉加举行的第32届欧洲肥胖症大会(ECO)上以口头报告形式亮相发布。HP515用于治疗MSH的中国临床试验申请于2024年8月获NMP批准,2025年1月完成首例受试者入组,目前正在进行中,初步数据表明药物的安全性、暴露量良好,且药效动力学符合预期。HP515用于治疗MSH的临床试验申请于2024年9月获得美国FD批准。
根据Stratistics Market Research Consulting数据,2023年全球减重及肥胖管理市场规模为2,829亿美元,预计2030年将增至5,549亿美元,年复合增长率达10.5%。HP515与GLP-1R激动剂联合使用的疗法可以提高GLP-1R激动剂的疗效,减少所需剂量,并将不良反应最小化,为肥胖和MSH提供了一种新的治疗方法。在食物诱导的代谢功能障碍相关脂肪性肝炎(MSH)小鼠模型中,HP515降低了小鼠肝脏重量、肝脏与体重比、血清甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)和肝脏脂质水平,并改善了非酒精性脂肪性肝病活动评分(NS),减少了肝脏纤维化。在食物诱导的肥胖小鼠模型中,司美格鲁肽(30 nmol/kg)组小鼠体重下降17.1%,30 nmol/kg司美格鲁肽与3 mg/kg HP515联用组和30 nmol/kg司美格鲁肽与30 mg/kg的HP515联合用药组小鼠体重分别下降30.2%和35.4%。与司美格鲁肽单药组相比,HP515与司美格鲁肽联合用药组体重下降的比例增加。司美格鲁肽(30 nmol/kg)与3 mg/kg或30 mg/kg的HP515联合用药组的瘦体重/体重比分别为62.3%和68.8%,与正常饮食组63.6%的瘦体重/体重比接近,而司美格鲁肽单药组的瘦体重/体重比为52.3%,表明HP515与GLP-1R激动剂联用能达到促进脂肪的减少并保持瘦体重/体重比的效果。此外,HP515与司美格鲁肽联合用药组还降低了小鼠肝脏TG、TC以及血浆TC、TG和LDL-C水平以及NS评分,表明HP515与GLP-1R激动剂联用能增强MSH治疗效果。RN测序结果显示,HP515单药和联合用药组均能通过上调脂肪酸代谢基因(CYP2E1和UCP1)促进白色脂肪棕色化及升热作用。HP515与替尔泊肽联用在降低体重和保持瘦体重/体重比的作用上和HP515与司美格鲁肽联用结果类似。
问:请PROTAC技术产品HP518的临床进展?
答:HP518是公司自主研发的新一代可口服给药的R PROTC分子,是国内首个进入临床试验阶段的口服R PROTC在研药物。HP518用于治疗转移性去势抵抗性前列腺癌(mCRPC)的中国Ⅰ期临床试验耐受性研究已完成,中国Ⅱ期临床试验已于2024年12月完成首例受试者入组,中国Ⅱ期临床试验正在进行中。此外,HP518同适应症临床试验申请已于2023年1月获美国FD批准,澳大利亚同适应症的Ⅰ期临床试验已完成,澳大利亚临床研究结果入选2024年1月美国临床肿瘤学会泌尿生殖系统肿瘤研讨会(SCO-GU),并入选2024年美国SCO年会。2025年5月,HP518澳大利亚临床Ⅰ期研究成果在国际期刊《Investigational New Drugs》发表。
此外,HP518片拟用于治疗雄激素受体(R)阳性三阴乳腺癌已获得美国FD授予快速通道认定(FTD)。HP518片获FTD,有利于公司提高与FD沟通效率,获得FD在药物开发过程中的指导,也有望通过优先审评缩短产品上市审评的时间,促使产品尽早实现商业化。
问:公司产品已获批上市,商业化策略和团队搭建情况?
答:公司正全面推进产品商业化落地筹备,已构建“医学-市场-准入-销售”四轮驱动的商业化策略,并以专业化学术推广为核心塑造品牌价值与临床治疗共识。公司拟采取自建团队和外部合作相结合的模式进行产品的市场推广。公司正在组建商业化团队,同时快速建立商业化渠道网络,确保新药上市批准后惠及更多的患者。
海创药业(688302)主营业务:以PROTAC靶向蛋白降解和氘代技术等平台为基础,专注于癌症、代谢性疾病等具有重大市场潜力的治疗领域的创新药物研发,以“创良药,济天下”为使命,以为患者提供安全、有效、可负担的药物为重点,致力于研发、生产及商业化满足重大临床需求、具有全球权益的创新药物。
海创药业2025年一季报显示,公司主营收入--,归母净利润-3210.18万元,同比上升32.01%;扣非净利润-3746.07万元,同比上升28.94%;负债率11.16%,投资收益192.05万元,财务费用-214.88万元。
该股最近90天内共有2家机构给出评级,买入评级1家,增持评级1家。
以下是详细的盈利预测信息:
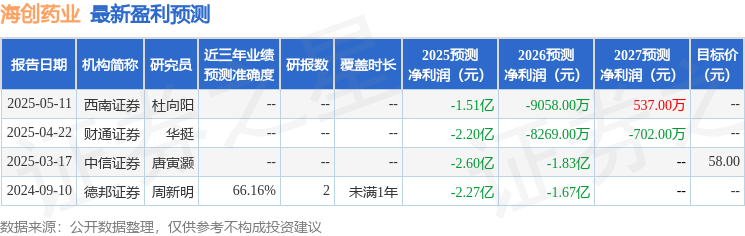
融资融券数据显示该股近3个月融资净流入9164.31万,融资余额增加;融券净流入0.0,融券余额增加。
以上内容为证券之星据公开信息整理,由AI算法生成(网信算备310104345710301240019号),不构成投资建议。
证星公司调研
2025-05-30
证星公司调研
2025-05-30
证星公司调研
2025-05-30
证星公司调研
2025-05-30
证星公司调研
2025-05-30
证星公司调研
2025-05-30
证券之星资讯
2025-05-30
证券之星资讯
2025-05-30
证券之星资讯
2025-05-30





