众生药业:5月6日接受机构调研,信达证券股份有限公司参与
来源:证星公司调研
2025-05-06 21:40:54
证券之星消息,2025年5月6日众生药业(002317)发布公告称公司于2025年5月6日接受机构调研,信达证券股份有限公司分析师参与。
具体内容如下:
问:公司2024年的业绩情况。
答:公司 2024年营业收入 246,741.84万元;归属于上市公司股东的净利润亏损 29,915.71万元;扣除非经常性损益后的净利润亏损 26,031.27万元。业绩变动原因为(1)公司核心产品复方血栓通系列制剂在 2023年 6月参与全国中成药联盟集中带量采购并成功中选。2023年 9月至报告期内,随着 30个省、直辖市、自治区药品招采中心陆续实施药品新中标价格,复方血栓通系列制剂受集采降价影响,公司业绩短期承压。(2)非经常性损益减少公司归属于上市公司股东的净利润 3,884.44万元。主要原因为:第一,公司与但丁生物科技(山东)有限公司(曾用名:上海沃立生物科技有限公司)就合作事宜产生分歧形成诉讼。公司根据二审判决结果计提预计负债,减少公司本报告期归属于上市公司股东的净利润。证券代码:002317 编号:2025-004第2页/共7页第二,公司持有的纳入交易性金融资产的股票公允价值对比期初下降,减少公司本报告期归属于上市公司股东的净利润。(3)2024年度,公司计提资产减值损失金额合计 54,668.07万元,减少公司 2024年度归属于母公司股东的净利润48,409.79万元。
问:公司 2024年资产减值情况。
答: 2024年度,公司计提资产减值损失金额合计54,668.07万元,减少公司 2024年度归属于母公司股东的净利润 48,409.79万元,并相应减少公司 2024年度归属于母公司所有者权益 48,409.79万元。主要减值情况:第一,公司对期末库存的存货和预计退回的商品进行全面清查。本期公司计提存货跌价损失、应收退货成本减值损失共 5,472.75万元,主要为公司产品来瑞特韦片及其部分未使用物料计提减值准备。第二,基于公司全资子先强药业、控股子公司逸舒制药相关产品受药品相关政策、行业竞争等因素影响,长期来看难以达到预期销售水平。基于谨慎性原则,公司根据《企业会计准则第 8号——资产减值》及相关规定,对两家收购的子公司股权形成的商誉计提减值准备。经测算,本期公司计提商誉减值损失共 20,167.71万元,本次计提完成后,先强药业、逸舒制药的商誉账面价值余额均为 0.00元。第三,根据《企业会计准则第 8号——资产减值》及相关规定,资产负债表日有迹象表明资产发生减值的,按无形资产可收回金额与账面价值的差异计提减值准备。基于谨慎性原则,公司计提无形资产减值损失共 7,916.66万元,主要为公司产品来瑞特韦片对应的无形资产计提减值准备。第四,随着公司重点创新药项目已陆续进入确证性临床试验阶段,公司基于经营和资源投入考虑,集中资源优先支持推进研发进度靠前、项目确定性高、未来市场空间大的项目。经公司详细论证,慎重决定暂缓ZSP1602、ZSP1241两项肿瘤创新药,以及 ZSP0678、ZSP1603证券代码:002317 编号:2025-004第3页/共7页等项目的研发投入。公司根据《企业会计准则第 8号——资产减值》及相关会计政策规定,基于谨慎性原则,对上述项目对应的开发支出计提资产减值损失 20,692.60万元。
问:公司 2025年一季度业绩情况。
答:展望 2025年,公司通过战略聚焦核心业务板块,深化资源整合配置、强化战略执行力度、系统推进成本管控体系升级,实现运营效率与盈利能力的双向提升。2025年一季度公司经营指标呈现改善态势,为全年高质量发展奠定基础。本报告期公司实现营业收入 63,426.14万元,同比减少 1.07%;实现归属于上市公司股东的净利润 8,261.18万元,同比增长61.06%;实现归属于上市公司股东的扣除非经常性损益的净利润 7,843.48万元,同比增加 8.60%。
问:公司创新药研发管线的布局。
答:公司已建立多模式良性循环的研发生态体系,构建自主研发为主、合作研发为有效补充的研发模式,主要聚焦代谢性疾病、呼吸系统疾病等疾病领域。截至目前,公司已有1个创新药项目获批上市,1个创新药项目的新药上市申请获得受理,多个创新药项目处于临床试验阶段。代谢性疾病研发管线,ZSP1601片是具有全新作用机制的治疗代谢功能障碍相关脂肪性肝炎(MASH)的一类创新药,为国家重大新药创制项目,也是首个完成健康人药代及安全性临床试验的用于治疗 MASH的国内创新药项目。目前已完成的Ib/IIa期临床试验结果表明,在 4周的治疗下,ZSP1601片明显地降低了 ALT、AST等肝脏炎症损伤标志物,同时多个纤维化相关生物标志物也有降低趋势,提示其具有改善肝脏炎症、坏死的潜力及抗纤维化的作用,研究结果已在自然杂志子刊《Nature Communications》发表。该项目正在开展 IIb期临床试验,参与者入组工作已完成。呼吸系统研发管线,口服单药抗新冠病毒 3CL蛋白酶抑证券代码:002317 编号:2025-004第4页/共7页制剂来瑞特韦片(商品名:乐睿灵®)已于 2023年 3月获得国家药品监督管理局附条件批准上市,并已纳入 2023年国家医保目录,有望惠及更多患者,为患者提供经济、安全、可及的用药选择。乐睿灵®从基础机制研究到临床试验的学术研究成果已经陆续发表于国际顶刊自然杂志子刊《 NatureMicrobiology 》和国际权威期刊柳叶刀杂志子刊《eClinicalMedicine》。2024年,来瑞特韦片列入《抗新型冠状病毒小分子药物临床应用专家共识》抗新冠病毒药物重点选择之一,其有效性和安全性获得专家认可,尤其推荐用于老年人群、肝肾功能不全等多种特殊人群新冠病毒感染的治疗,并且肝肾功能不全患者使用来瑞特韦片时无需调整剂量。昂拉地韦片(商品名:安睿威®)是具有明确作用机制和全球自主知识产权的 PB2靶点 RNA聚合酶抑制剂,临床上拟用于成人单纯性甲型流感的治疗。安睿威®与奥司他韦胶囊头对头、安慰剂对照治疗成人甲型流感的 III期临床试验结果表明,安睿威®在主要终点指标七项流感症状缓解时间(TTAS)、次要终点指标包括单系统或单症状指标缓解时间、病毒学指标(如病毒载量下降、病毒转阴时间、病毒转阴参与者比例)等均优于安慰剂组,达到统计学显著性差异。安睿威® II期临床试验结果发表在柳叶刀杂志子刊《The LancetInfectious Diseases》,III期临床试验结果的 SCI文章在审稿阶段。安睿威®的新药上市申请已获得 NMPA受理,正在审评审批进程中。此外,为方便特殊人群包括儿童患者以及吞咽困难患者用药,公司启动昂拉地韦颗粒治疗 2~17岁单纯性甲型流感患者的 II期临床试验,该研究组长单位为首都医科大学附属北京儿童医院,全国 30余家中心,目前,参与者入组工作已完成。
问:公司代谢性疾病的新药情况及进展。
答:公司布局治疗代谢性疾病方面一类创新药时间较早,证券代码:002317 编号:2025-004第5页/共7页针对代谢性疾病因复杂多样、病程较长的特点,公司布局了几个小分子创新药。ZSP1601片是具有全新作用机制的治疗非酒精性脂肪性肝炎(NASH)的一类创新药,为国家重大新药创制项目,也是首个完成健康人药代及安全性临床试验的用于治疗 NASH的国内创新药项目。目前已完成的 Ib/IIa期临床研究表明,在 4周的治疗下,ZSP1601明显地降低了 ALT、AST等肝脏炎症损伤标志物,同时多个纤维化相关生物标志物也有降低趋势,提示其具有改善肝脏炎症、坏死的潜力及抗纤维化的作用,研究结果已在自然杂志子刊《Nature Communications》发表。目前,该项目正在开展 IIb期临床研究,参与者入组工作已完成。RAY1225注射液是拥有全球自主知识产权的长效 GLP-1类创新结构多肽药物,具备 GLP-1受体和 GIP受体双重激动活性,临床上拟用于 2型糖尿病及超重/肥胖等患者的治疗,拟推荐为两周给药一次的双周制剂。RAY1225注射液在治疗中国超重/肥胖参与者(REBUILDING-1研究)与 2型糖尿病参与者(SHINING-1研究)的两项Ⅱ期临床试验已披露 PartA子研究的顶线分析数据结果,达到主要终点;在美国开展超重/肥胖参与者的 II期临床试验申请获得 FDA批准;RAY1225注射液治疗超重/肥胖参与者的 III期临床试验(REBUILDING-2研究)已获得组长单位伦理批件,标志着 RAY1225注射液 III期临床试验将全面启动。
问:RAY1225注射液II期临床试验的结果。
答:RAY1225注射液是公司研发的、具有全球自主知识产权的创新结构多肽药物,属于长效GLP-1类药物,具有GLP-1受体和GIP受体双重激动活性,可通过刺激胰岛素分泌、延缓胃排空等机制调节人体代谢和控制血糖,有望用于降糖、减肥、代谢综合征等多种代谢性疾病的治疗。RAY1225注射液临床拟证券代码:002317 编号:2025-004第6页/共7页用于成人2型糖尿病及肥胖/超重等患者的治疗,目前两项研究处于II期临床试验阶段,用于肥胖/超重患者及2型糖尿病患者的II期临床试验都于近期完成Part A子研究的数据清理和锁定,获得顶线分析结果,达到主要终点。(1)减重Ⅱ期临床试验相关情况Part A较低剂量平行研究部分中,肥胖/超重参与者接受RAY1225注射液 3mg、6mg和安慰剂共入组 122例,每两周给药一次,连续治疗 24周。结果显示, RAY1225注射液 3mg组(1mg起始,第 8周滴定到目标剂量并维持 16周,总剂量为30mg)和 6mg组(1mg起始,第 12周滴定到目标剂量并维持12周,总剂量为 50mg),两组体重呈剂量依赖性下降,体重相对变化的最小二乘均数分别为-10.06%和-12.97%,安慰剂组为-3.62%,两组体重下降均显著优于安慰剂组(P<0.001)。(2)降糖Ⅱ期临床试验相关情况在 Part A较低剂量平行研究部分,2型糖尿病参与者接受 RAY1225注射液 3mg、6mg和安慰剂共入组 123例,每两周给药一次(Q2W),连续治疗 24周。 RAY1225注射液 3mg组(1mg起始,第 8周滴定到目标剂量并维持 16周,总剂量为30mg)、6mg组(1mg起始,第 12周滴定到目标剂量并维持12周,总剂量为 50mg),两组的糖化血红蛋白(HbA1c)呈剂量依赖性下降,治疗 24周 HbA1c较基线变化的最小二乘均数分别为-1.67%、-2.07%,安慰剂组为-0.23%,两组 HbA1c下降情况均显著优于安慰剂组(P<0.0001)。RAY1225注射液 3mg~9mg在肥胖/超重参与者及 2型糖尿病参与者中安全性、耐受性良好,整体安全性特征与 RAY1225注射液既往临床研究和 GLP-1类药物类似,低血糖风险低,未发现新增安全性信号。最常见的为胃肠道相关不良反应,严重程度大多较轻微。RAY1225注射液治疗肥胖/超重患者与2型糖尿病患者的证券代码:002317 编号:2025-004第7页/共7页| |两项II期临床研究仍在进行中。RAY1225注射液收到美国食品药品监督管理局签发的药物临床试验批准通知书,RAY1225注射液可直接在美国开展超重或肥胖适应症的II期临床试验。公司于近日获得RAY1225注射液治疗肥胖/超重参与者III期临床试验伦理批件,公司将继续按照相关要求高质量、加速度、科学规范地推进临床试验。
问:公司流感新药情况。
答:昂拉地韦片(商品名:安睿威®)作为国内第一个获批临床的甲型流感病毒RNA聚合酶抑制剂,对包括奥司他韦耐药株、高致病性禽流感病毒株和巴洛沙韦耐药株等在内的多种不同亚型流感病毒株具有强大的抑制活性,已完成与奥司他韦胶囊头对头、安慰剂对照的III期成人甲流临床试验顶线数据分析结果:该试验获得了积极结果,本研究已达到方案预设的主要疗效终点指标,且安全性良好。安睿威的新药上市申请已获得国家药品监督管理局受理,正在审评审批进程中,公司将在符合药品注册申请的相关法律法规下,积极推进安睿威的药品注册和上市申请的各项工作,并与国家药品监督管理局药品审评中心(CDE)保持密切沟通。
众生药业(002317)主营业务:药品研发、生产、销售。
众生药业2025年一季报显示,公司主营收入6.34亿元,同比下降1.07%;归母净利润8261.18万元,同比上升61.06%;扣非净利润7843.48万元,同比上升8.6%;负债率21.76%,投资收益417.96万元,财务费用-2.35万元,毛利率56.58%。
该股最近90天内共有1家机构给出评级,买入评级1家;过去90天内机构目标均价为17.01。
以下是详细的盈利预测信息:
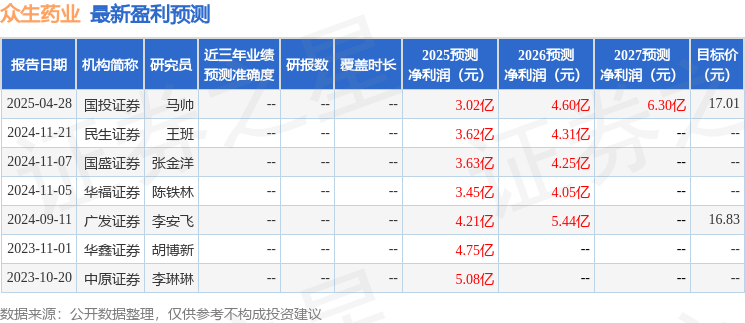
融资融券数据显示该股近3个月融资净流出3439.42万,融资余额减少;融券净流出71.46万,融券余额减少。
以上内容为证券之星据公开信息整理,由AI算法生成(网信算备310104345710301240019号),不构成投资建议。
证星公司调研
2025-06-20
证星公司调研
2025-06-20
证星公司调研
2025-06-20
证星公司调研
2025-06-20
证星公司调研
2025-06-20
证星公司调研
2025-06-20
证券之星资讯
2025-06-20
证券之星资讯
2025-06-20
证券之星资讯
2025-06-20





